Meilensteine auf dem Weg zur klinischen Bewertung

Die klinische Bewertung bezeichnet einen systematischen und geplanten Prozess zur kontinuierlichen Generierung, Analyse und Bewertung der klinischen Daten zu einem Produkt. Sie wird für alle Medizinprodukte gefordert, unabhängig von der Risikoklasse. Sie bewertet das Nutzen-Risikoverhältnis anhand von ausreichend klinischen Daten. Gemäß der MDR soll die klinische Bewertung dem Produkt, seinen Eigenschaften und der Zweckbestimmung angemessen sein. Doch was bedeutet „angemessen“ und wann sind die Daten „ausreichend“? Dieser Artikel beschreibt die 6 Meilensteine zu einer erfolgreichen klinischen Bewertung.
Gruppierung der Produkte für die klinische Bewertung
Im ersten Schritt ist es ratsam, sich Gedanken darüber zu machen, für welche Produkte in der klinischen Bewertung überhaupt betrachtet werden sollen. Manchmal handelt es sich um ein einzelnes Produkt, dann ist die Sachlage klar. Doch oft bietet es sich an, mehrere Produkte in einer klinischen Bewertung gemeinsam zu betrachten.
Bei großen Produktgruppen, die auf gleicher Technologie basieren und eine gemeinsame Zweckbestimmung teilen, bietet sich eine gemeinsame Bewertung an. Wenn auch die Prozesse des „Berichtswesens“ - also des Riskomanagements und der Nachmarktbeobachtungsprozesse - auf einander abgestimmt sind, können viele Redundanzen eingespart werden (siehe unten).
In anderen Fällen werden Produkte gemeinsam im medizinischen Alltag eingesetzt und bilden so einen Wirkverbund. Bei solchen Systemen können die Einzelprodukte die gewünschte medizinische Wirkung alleine nicht erreichen. Daher kann die Leistung und die Sicherheit dieser Produkte auch nur gemeinsam betrachtet und demonstriert werden. In solchen Fällen kann die Gruppierung sinnvoll sein, selbst wenn die Produkte unterschiedliche Technologien darstellen und unterschiedlichen Risikoklassen angehören. Dabei würde man das Vorgehen an dem Produkt mit der höchsten Risikoklasse ausrichten. Das kann zwar dazu führen, dass Dokumente wie der PSUR für manche Produkte „überflüssigerweise“ oder „zu häufig“ erstellt werden. Dies macht aber die Übersicht und die Argumentation sehr viel einfacher.
Standortbestimmung – Mit welcher Kategorie Produkt trete ich an?
Es ist wichtig, sich direkt zu Beginn klarzumachen, welche Daten und Datenquellen zur Verfügung stehen. Wie die Ansprüche an die klinische Bewertung aber genau aussehen, hängt vor allem von der Risikoklasse des Produktes ab.
Die Produkte lassen sich dabei in zwei in zwei grobe Kategorien unterscheiden: Hochrisiko-Produkte, also Klasse III und Implantate und Niedrigrisiko-Produkte also nicht-implantierbare Produkte der Klassen I bis IIb.
Für Hochrisiko-Produkte werden im Artikel 61(4) klinische Prüfungen gefordert. Für Niedrigrisiko-Produkte wird dagegen dazu keine explizite Aussage gemacht. Aber auch hier muss die klinische Bewertung auf „ausreichend klinischen daten“ basieren. Was „ausreichend“ ist, wird von Fall zu Fall bewertet.
Für „klinische Daten“ gibt die MDR 2 (48) aber eine genaue Definition an. Nur Daten die mit dem eigentlichen Produkt oder einem Äquivalenzprodukt gesammelt worden sind „klinische Daten“ gemäß der MDR. Daten zu der generischen Produktgruppe sind demnach keine „klinischen Daten“. Dennoch können in Fällen von etablierten Technologien (well-established technology) laut des MDCG-Dokumentes 2020-6 auch solche Daten herangezogen werden. Daher sind die grundsätzlichen Überlegungen zu Äquivalenzbetrachtungen und der kritischen Bewertung der vorhandenen Evidenz anzustellen.
Wahl der Strategie der klinischen Bewertung
Es stehen mehrere Routen für die klinische Bewertung zur Verfügung. Vor der Erstellung der klinischen Bewertung sollten sich Hersteller mit folgenden Fragen auseinander setzten:
- Welche Erfahrungswerte/welche Datenlage ist vorhanden?
- Kann das Nutzen-Risikoverhältnis definiert werden; gibt es unkontrollierte Restrisiken?
- Welche Fragen bezüglich Leistung, Sicherheit und klinischen Nutzens des Produkts sind noch offen?
- Kann die Datenlücke mit präklinischen Methoden geschlossen werden, oder sind klinische Daten erforderlich?
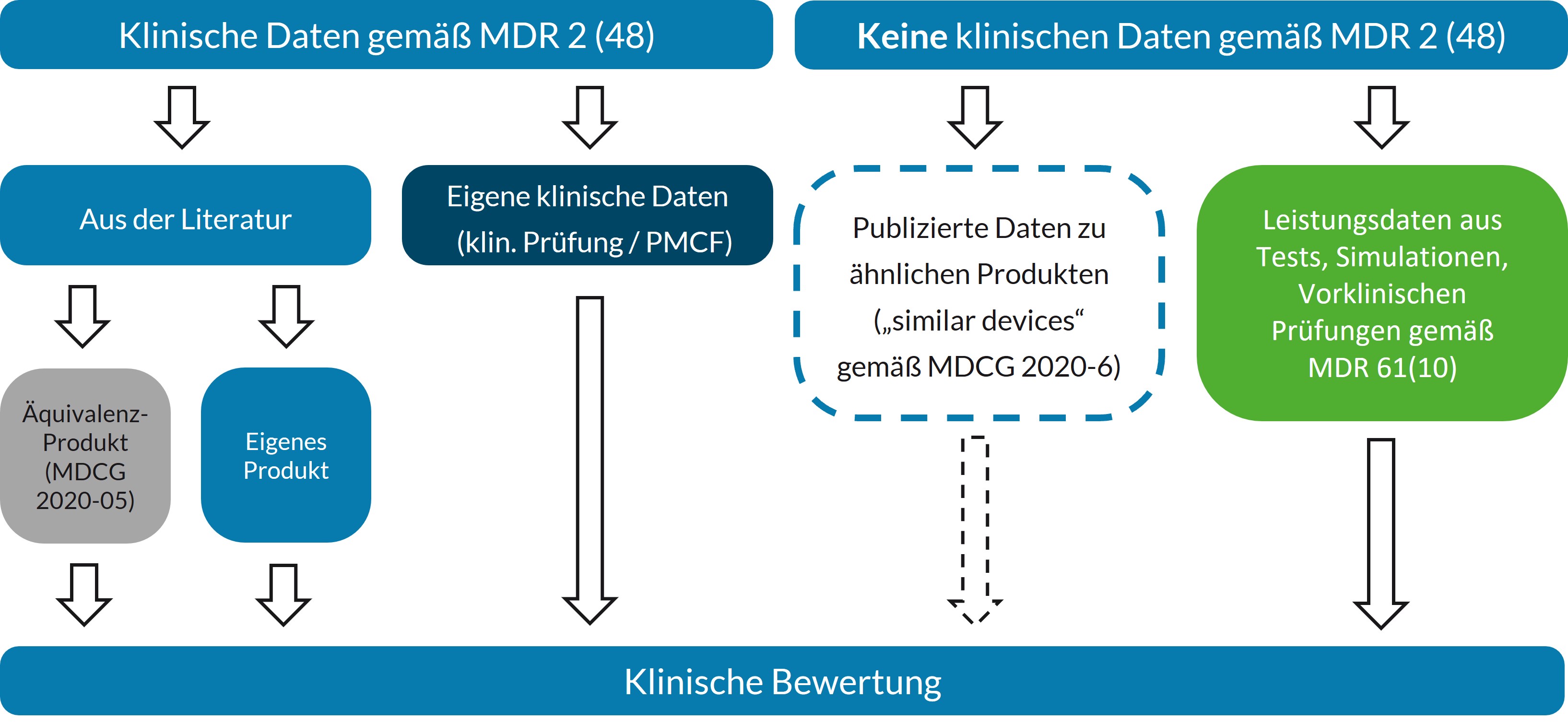
Direkte Evidenz: Eigene Daten
Die MDR zeichnet eine gewisse Rangfolge bei der Definition der klinischen Daten. Klinische Prüfungen des betreffenden Produktes stehen dabei an erster Stelle. Zusammen mit klinisch relevanten Angaben aus der klinischen Nachbeobachtung nach dem Inverkehrbringen (PMCF) bilden sie die „direkte Evidenz“ zum Produkt. Diese Daten können sowohl in medizinischen Fachzeitschriften publiziert als auch proprietäre klinische Daten sein.
Indirekte Evidenz: Äquivalenz
Produkt mit Fremdäquivalenz nach MDR 61(5)
Die Äquivalenzroute, die früher die Hauptform der klinischen Bewertung dargestellt hat, hat unter der MDR viele Nachteile. Zum einen ist diese Route „regulatorisch instabil“. Denn wenn bei dem Äquivalenzprodukt sich die Zweckbestimmung ändert – zum Beispiel Indikationen wegfallen oder Kontraindikationen hinzukommen – brechen in der klinischen Bewertung Argumentationslinien weg.
Zum anderen strebt die MDR an, dass die Hersteller sich möglichst von der Äquivalenzroute lösen und die Konformität mit den grundlegenden Sicherheits- und Leistungsparametern (GSPR) durch direkte klinische Evidenz belegen. Daher sind die Äquivalenzkriterien - unabhängig von der Risikoklasse - unter der MDR strikter geworden (MDR, Anhang XIV, Teil A(3) und MDCG-2020-5).
Darüber hinaus wird ein hinreichender Zugang zu den notwendigen Informationen für die Äquivalenzbetrachtung gefordert. Bei „Hochrisiko-Produkten“ fordert die MDR einen „uneingeschränkte[n] Zugang zur technischen Dokumentation“, der nur in den seltensten Fällen vorliegt. Aber auch bei „Niedrigrisiko-Produkten “ können öffentlich verfügbare Informationen nicht ausreichend sein.
Produkt mit Binnenäquivalenz nach MDR 61(4)
Gerade für Hochrisiko-Produkte kann es sich anbieten, in der klinischen Bewertung die Route der Binnenäquivalenz zu wählen. Dabei wird die Äquivalenz zu einen Vorgängerprodukt oder einem ähnlichen Produkt aus dem eigenen Portfolio postuliert. Wenn die Äquivalenzkriterien erfüllt werden können, ist das ein guter Weg, neue Produkte in die MDR zu bringen.
Leistungsdaten 61(10)
Die MDR räumt die Möglichkeit ein, dass „klinische Daten“ nicht geeignet sein können, um die Konformität eines Produktes mit den GSPR zu zeigen. In diesem Fall fußt die klinische Bewertung auf Leistungsdaten aus Tests, Simulationen oder vorklinischen Prüfungen. Diese Route ist vor allem für einfache Produkte geeignet, die keinen eigenständigen medizinischen Zweck erfüllen (wie Ausstattungsgegenstände) oder deren Funktion besser im Tiermodell oder einem Benchtest geprüft werden kann als in klinischen Studien. Wichtig ist, dass für diese Produkte kein direkter klinischer Nutzen – also z.B. verbesserte Sicherheit oder Leistung – postuliert werden darf.
Die Leistungsdaten-Route steht nur für „Niedrigrisiko-Produkte“ offen. Denn der Artikel 61(10) stellt klar, dass der Artikel 61 (4) dem übergeordnet ist, in dem für Klasse III Produkte und Implantate klinische Prüfungen gefordert werden.
Einfache Implantate: Well-established technology 61(6b)
Eine weiterer Ausnahmefall, in welchem auf „klinische Daten“ gemäß der MDR verzichtet werden kann, stellen die Produkte der Gruppe „Well-established technology“ dar. Die MDR benennt dabei einfache Implantate wie Schrauben, Platten und Nahtmaterial (MDR 61 (6b)). Das MDCG 2020-6 Dokument ergänzt, dass auch andere Produkte als „Well-established technology“ betrachtet werden können, wenn sie bestimmte Kriterien erfüllen (siehe MDCG 2020-6, Abschnitt 1.2). Für diese Produkte sind auch Daten zu ähnlichen Produkten („similar devices“) für die klinische Bewertung relevant, auch wenn sie nicht die Definition der „klinischen Daten“ gemäß MDR 2 (48) erfüllen.
Bestandsprodukte (Legacy device 61 (6a))
Bestandsprodukte (legacy devices), die bereits unter der MDD die CE-Kennzeichnung erhalten haben, bilden eine weitere Ausnahme. Laut MCDG 2020-6 sollen die klinischen Daten nach dem Inverkehrbringen zusammen mit den klinischen Daten, die für die Konformitätsbewertung im Rahmen der MDD/AIMDD generiert wurden, die Grundlage für die klinische Bewertung unter der MDR bilden.
Plan zur klinischen Bewertung
Der Plan zur klinischen Bewertung ordnet das Produkt regulatorisch und klinisch ein und definiert die Bewertungsstrategie. Eine der größten Herausforderungen beim Erstellen des Plans zur klinischen Bewertung ist die Definition der Sicherheits- und Leistungsparametern, anhand derer das Produkt und das Nutzen-Risiko-Verhältnis bewertet werden sollen. Im Optimalfall sind diese Parameter aus der Literatur zum Stand der Technik ableitbar, quantifizierbar und dienen als Endpunkte in publizierten wissenschaftlichen Studien. In diesem Fall kann die Leistung und Sicherheit des betreffenden Produktes bequem mit dem State-of-the-Art verglichen werden.
Leider tritt der Optimalfall selten ein. Oft sind die Parameter, an welchen man die Sicherheit und Leistung eines Produktes sinnvoll messen kann, nicht im Fokus der klinischen Forschung. In so einem Fall ist der Vergleich von Daten zum eigenen oder dem Vergleichsprodukt und alternativen Behandlungen nicht möglich. Bei solchen Produkten ist es besonders wichtig, die Parameter und die Methoden zur Bewertung mit Bedacht zu definieren, damit die gestellten Fragen auch beantwortet werden können.
Prozesse aufeinander Abstimmen
Die klinische Bewertung dient als grundlegender Prozess zur Identifizierung und Analyse klinischer Daten, um die Konformität eines Medizinprodukts mit den Grundlegenden Sicherheits- und Leistungsanforderungen (GSPRs) nachzuweisen. Während dieser systematischen Beurteilung können Lücken in den klinischen Daten identifiziert werden, die unbeantwortete Fragen zur Leistung oder zum Sicherheitsprofil des Produkts offenlegen.
Darüber hinaus kann die klinische Bewertung potenzielle Mängel in der Risikomanagement-Dokumentation feststellen. Diese erkannten Lücken und Unsicherheiten müssen durch gut konzipierte Pläne zur Marktbeobachtung nach dem Inverkehrbringen (PMS) und zur klinischen Nachbeobachtung nach dem Inverkehrbringen (PMCF) systematisch adressiert werden. Da PMS- und PMCF-Aktivitäten neue klinische Erkenntnisse und Evidenz aus der Praxis generieren, müssen diese Ergebnisse in nachfolgende klinische Bewertungen einbezogen werden, wodurch ein kontinuierlicher Feedback-Kreislauf entsteht.
Diese neuen Informationen können Aktualisierungen der Nutzen-Risiko-Verhältnis-Bewertung erforderlich machen und entsprechende Änderungen an der Risikomanagement-Dokumentation auslösen. Dieser vernetzte, zyklische Ansatz stellt sicher, dass klinische Bewertung, PMS, PMCF und Risikomanagement gemeinsam die Sicherheit und Leistung des Medizinprodukts während seines gesamten Lebenszyklus aufrechterhalten und sowohl die regulatorischen Anforderungen als auch die Zweckbestimmung des Produkts erfüllen.
Für ein optimales Funktionieren dieses Systems ist eine sorgfältige zeitliche Abstimmung der verschiedenen Berichte und Pläne unerlässlich, damit die gewonnenen Erkenntnisse rechtzeitig in die jeweils nachfolgenden Prozesse einfließen können und regulatorische Fristen eingehalten werden.
Aufbau einer PMCF-Strategie
Die klinische Nachmarktbeobachtung (PMCF) ist unter der MDR eine essenzielle Aktivität. Die PMCF bietet eine wichtige Quelle eigener klinischer Daten für künftige Konformitätsbewertungsverfahren. Bei Produkten, die mithilfe der Äquivalenzroute die CE-Kennzeichnung erreicht haben, sollte PMCF darauf abzielen, sich von diesem Datensatz unabhängig zu machen. Denn sollten Probleme mit dem Äquivalenzprodukt auftreten oder es vom Markt genommen werden, kann man schnell argumentativ in der Bewertung des eigenen Produktes in Rückenlage geraten.
Alles bereit?
In der klinischen Bewertung kommen die technischen Daten, die publizierte Literatur, das Risikomanagement und die Nachmarktbeobachtung zusammen. Es ist ein dynamischer Prozess, der die Sicherheit und Leistungsfähigkeit von Medizinprodukten über ihren gesamten Lebenszyklus sicherstellt. Die sechs vorgestellten Meilensteine – von der Produktgruppierung über die Strategiewahl bis zur PMCF-Planung – bilden einen strukturierten Rahmen. Entscheidend ist die Integration von klinischer Bewertung, Risikomanagement und Nachmarktbeobachtung zu einem kohärenten System. Hersteller, die diesen Ansatz verfolgen, erfüllen nicht nur regulatorische Anforderungen, sondern gewinnen wertvolle Erkenntnisse zur kontinuierlichen Produktverbesserung und stärken letztlich das Nutzen-Risiko-Verhältnis ihrer Produkte zum Wohle der Patient/innen.

