Typen von Klinischen Studien

Für Medizinprodukte existieren verschiedene Studientypen. Die Wahl hängt dabei vom regulatorischen Status, dem Zeitpunkt im Lebenszyklus des Produkts und der Art des Produkts ab. Mitunter kommen unterschiedliche Ansätze in Betracht. Im Folgenden beschreiben wir die relevanten Studientypen.
Klinische Prüfung oder klinische Studie?
Zuerst ist es wichtig, die Begriffe zu klären. Die MDR und das MPDG verwenden den Begriff (sonstige) klinische Prüfung. Die MDR regelt klinische Prüfungen vor CE-Kennzeichnung sowie nach CE-Kennzeichnung, wenn die Prüfung zusätzliche invasive oder belastende Maßnahmen beinhaltet. Die Durchführung einer klinischen Prüfung mit einem CE-gekennzeichneten Produkt innerhalb der Zweckbestimmung ohne zusätzliche invasive oder belastende Maßnahmen wird durch die MDR jedoch nicht geregelt. Daher wird diese Art der klinischen Studie auch nicht als „klinische Prüfung“ bezeichnet. Die ISO 14155 setzt die Begriffe „klinische Prüfung", „klinischer Versuch" und “klinische Studie" gleich.
Ob klinische Prüfung vor CE, nach CE mit zusätzlichen invasiven oder belastenden Maßnahmen, PMCF-Studie oder sonstige klinische Prüfung: zur Vereinfachung verwenden wir übergreifend die Bezeichnung „klinische Studien“, wenn wir uns nicht explizit auf eine klinische Prüfung oder PMCF-Studie beziehen. Eine Hilfe bei der Einordnung sowie eine Übersicht liefert der Entscheidungsbaum vom Bundesministerium für Bildung und Forschung, veröffentlicht im Medtec Online-Leitfaden. Im Nachfolgenden werden die einzelnen Studientypen näher beleuchtet.
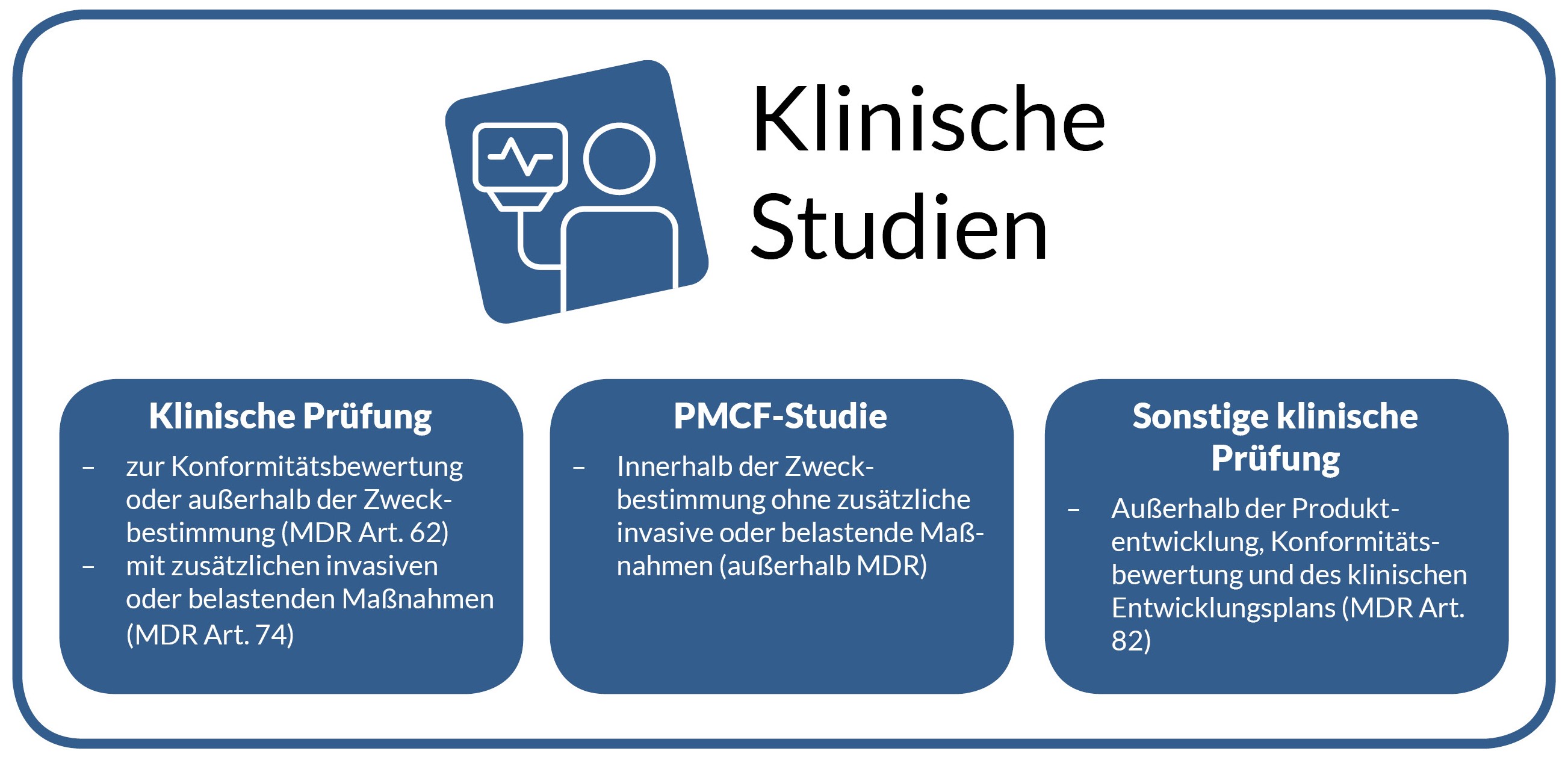
Klinische Prüfungen zum Nachweis der Konformität oder mit CE-gekennzeichnetem Produkt außerhalb der Zweckbestimmung (nach MDR Artikel 62)
Bei einer klinischen Prüfung nach Artikel 62 der MDR handelt es sich um eine klinische Prüfung zur Erfüllung der grundlegenden Sicherheits- und Leistungsanforderungen nach Anhang I der MDR, bevor das Medizinprodukt rechtmäßig in Verkehr gebracht wird. Es soll gezeigt werden, dass das Medizinprodukt seinen Zweck und den ausgelobten Nutzen erfüllt und sicher ist.
Es gibt verschiedene Möglichkeiten eine klinische Prüfung „vor-CE“ durchzuführen. Hierzu zählen beispielsweise randomisiert kontrollierte Prüfungen oder nicht-randomisierte Prüfungen mit oder ohne Verblindung. In allen Fällen ist eine zustimmende Stellungnahme der Ethikkommission und eine Genehmigung der Bundesoberbehörde notwendig, um mit der klinischen Prüfung beginnen zu können. Zudem wird hier eine Versicherung für die Patienten benötigt, da die Studienprozedur nicht als Teil der klinischen Routine gesehen werden kann. Die Patienten müssen in die Teilnahme an der klinischen Prüfung und somit in die Anwendung des Prüfprodukts (in der Interventionsgruppe) oder einer Randomisierung in eine Kontrollgruppe, falls vorgesehen, nach Aufklärung einwilligen. Diese Art der klinischen Prüfung ist hochreguliert und mit diversen Anforderungen an das Prüfteam (z.B. Qualifikationsnachweise und Erfahrung) und den Sponsor (z.B. Verankerung der Sponsor-Tätigkeiten im QM-System, Einhaltung besonderer Meldepflichten, rechtliche Anforderungen, Überwachungsaufgaben) verbunden.
Klinische Prüfungen mit CE-gekennzeichneten Produkten nach MDR Artikel 74 – mit zusätzlichen invasiven oder belastenden Maßnahmen
In Artikel 74 der MDR sind klinische Prüfungen mit Medizinprodukten, die bereits ein CE-Kennzeichen tragen, definiert. Hierbei handelt es sich um klinische Prüfungen, die im Rahmen der Überwachung nach dem Inverkehrbringen und zusätzlich mit belastenden oder invasiven Maßnahmen durchgeführt werden. Sie dienen laut ISO 14155 Anhang I I.2.3 zum Zweck, weitere klinische Daten zur klinischen Leistungsfähigkeit, Wirksamkeit oder Sicherheit eines Medizinproduktes zu erhalten, und spezifische Fragen zu beantworten. Es sollen Häufigkeiten von Restrisiken oder Nebenwirkungen nach dem Konformitätsbewertungsverfahren neu abgeschätzt werden oder unbekannte Risiken identifiziert werden, da eine höhere Patientenzahl über einen längeren Zeitraum beobachtet wird.
Werden in der klinischen Prüfung nach CE zusätzliche invasive oder belastende Maßnahmen im Vergleich zum Routineeinsatzangewendet, wird eine zustimmende Stellungnahme durch die Ethikkommission und eine Anzeige bei der Bundesoberbehörde vor Beginn der Rekrutierung benötigt. Auch hier ist eine Einwilligung nach Aufklärung des Patienten nötig, da es sich auch hier um studienspezifische Maßnahmen außerhalb der klinischen Routine handelt. Je nach Art der zusätzlichen Maßnahmen muss über den Abschluss einer Versicherung entschieden werden.
PMCF-Studien nach (ärztlicher) Berufsordnung – mit CE-gekennzeichneten Produkten ohne zusätzliche invasive oder belastende Maßnahmen: Daten aus der klinischen Routine
Studien mit Medizinprodukten, die bereits das CE-Kennzeichen tragen, und die innerhalb ihrer Zweckbestimmung und ohne zusätzliche invasive oder belastende Maßnahmen untersucht werden, werden nicht durch die MDR abgedeckt. Es handelt sich um biomedizinische Forschung am Menschen, bei der sich der Hauptprüfer einer berufsrechtlichen Beratung durch die Ethikkommission nach § 15 der Berufsordnung für Ärzte unterziehen muss. Diese Studien sind klassischerweise „Beobachtungsstudien“, in denen Daten aus der klinischen Routine gesammelt und ausgewertet werden. Eine einfache und effektive Art der Datensammlung ist in dem Fall z.B. ein Register oder eine Anwenderbefragung.
Da es in dieser Art der Studie nicht um die Studienprozedur mit dem zu untersuchenden Medizinprodukt geht, sondern nur um eine Auswertung bereits in der Krankenakte befindlicher Daten, wird nur eine Zustimmung zur Datenverarbeitung (gemäß Datenschutzgrundverordnung, DSGVO) und ggf. eine Entbindung von der Schweigepflicht durch den Patienten benötigt.
DiGA ein besonderer Typ der PMCF-Studie: Von der Konzeptionierung bis zur Listung
Digitale Gesundheitsanwendungen, kurz DiGA, sind in aller Munde. Seit 2019 gibt es das Digitale Versorgungs-Gesetz (DVG), das gesetzlich Versicherten einen Anspruch auf die Versorgung mit DiGAs auf Verordnung von Ärzten oder Psychotherapeuten bescheinigt. Bei Vorliegen einer entsprechenden Indikation kann die Krankenkasse auch ohne ärztliche Verordnung eine DiGA-Nutzung erstatten. Als eine rein deutsche Erfindung und mit sehr konkreten Anforderungen seitens des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) ist es nicht trivial alle erforderlichen Schritte in kurzer Zeit zu gehen (Stichwort „Fast track-Verfahren“) und mit einer DiGA-Listung die (dauerhafte) Erstattbarkeit der DiGA oder umgangssprachlich der „App auf Rezept“ zu erreichen. Der Erprobungszeitraum für die nachzuweisenden positiven Versorgungseffekte ist hierbei auf ein Jahr begrenzt, in Ausnahmefällen auf zwei Jahre. Mit unserer Erfahrung können wir Sie sicher durch die Vorgaben aus der Digitale Gesundheitsanwendungen-Verordnung (DiGAV) und dem DiGA-Leitfaden bringen – egal ob Sie zunächst eine vorläufige Listung anstreben oder sofort die endgültige.
Das BfArM hat besondere Anforderungen an Ihre Studie gestellt? Wir finden gemeinsam eine zufriedenstellende Lösung – von der Pilotstudie über die RCT bis hin zur Listung. Hierbei gibt es Tätigkeiten zusätzlich zu jenen in klinischen Prüfungen oder „klassischen“ PMCF-Studien umzusetzen:
- Teilnahme an Beratungsterminen mit dem BfArM, z.B. zu Strategien zum Diagnosenachweis, Pilotstudie vs. Hauptstudie, etc.
- Erstellung des Evaluationskonzepts
- Alternative Wege der Patientenrekrutierung
Besondere Herausforderungen an diese Art der Studie liegen in der Natur der Nutzung einer App als Medizinprodukt. Gerne suchen wir mit Ihnen neue Wege, Teilnehmer für die Studie zu rekrutieren und damit auch spätere Vertriebswege zu etablieren. Um die Studien möglichst digital und soweit möglich unabhängig von Prüfzentren durchzuführen, können neben elektronischen Fragebögen auch online Randomisierung und eConsent in Ihrer Studie berücksichtigt werden. Basierend auf dem Studienplan entscheiden wir mit Ihnen gemeinsam, ob ein klassisches Monitoring für die Studie möglich ist und begründen diese Entscheidungen auch gegenüber z.B. Ethikkommissionen oder dem BfArM.
Sonstige klinische Prüfungen (MDR Artikel 82)
Eine weitere Sonderform der klinischen Prüfung ist die „sonstige klinische Prüfung“. Sie wird in MDR Artikel 82 erwähnt, aber erst in der nationalen Gesetzgebung (hier MPDG §47) genauer erläutert. Es handelt sich um eine sonstige klinische Prüfung laut MPDG, Artikel 1, § 3, wenn sie:
- nicht Teil eines systematischen und geplanten Prozesses zur Produktentwicklung oder der Produktbeobachtung eines gegenwärtigen oder künftigen Herstellers ist,
- nicht mit dem Ziel durchgeführt wird, die Konformität eines Produktes mit den Anforderungen der Verordnung (EU) 2017/745 nachzuweisen,
- der Beantwortung wissenschaftlicher oder anderer Fragestellungen dient und außerhalb eines klinischen Entwicklungsplans nach Anhang XIV Teil A Ziffer 1 Buchstabe a der Verordnung (EU) 2017/745 erfolgt.
Somit sind die sonstigen klinischen Prüfungen irrelevant für die regulatorischen Prozesse bei Herstellern, sondern decken den Forschungsbedarf von Ärzten als prüfergetriebene Prüfung (investigator-initiated trials, IIT) ab. Je nachdem ob auch hier wieder zusätzliche invasive oder belastende Maßnahmen durchgeführt werden sollen, ist eine zustimmende Stellungnahme der Ethikkommission und eine Anzeige bei der Bundesoberbehörde notwendig oder eine berufsrechtliche Beratung nach § 15 der Berufsordnung für Ärzte ausreichend.

